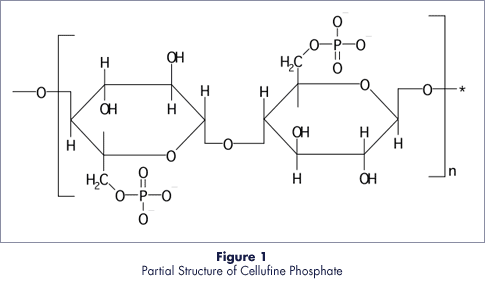
セルファインTMフォスフェイト
mRNA薬の合成酵素となるT7 RNAポリメラーゼなど核酸結合タンパク質の精製に
セルファイン フォスフェイトは酵素や、核酸結合性タンパク質にアフィニティ活性のあるクロマトグラフィー充填剤です。 真球状の機械的強度の高いセルロース粒子にリン酸エステル基を固定化しています。 mRNA薬の合成酵素となるT7 RNAポリメラーゼは核酸結合タンパク質のためセルファイン フォスフェイトで効率的な精製を行うことができます。
| 特徴 | |
|---|---|
| ベース担体 | Cellulose |
| リガンド | リン酸エステル基 |
| リガンド濃度 | 0.3 - 0.8meq/ml |
| タンパク質吸着量 | ≧ 20mg/ml-gel (リゾチーム) |
T7 RNAポリメラーゼの精製事例Purification of T7 RNA polymerase
T7 RNAポリメラーゼはインビトロ転写合成において、鋳型DNAからmRNAを合成するために使用される極めて重要なRNA合成酵素です。 この事例では最初にセルファインMAX DEAEによる粗精製を行った後に、セルファイン フォスフェイトによるアフィニティー精製を行う2段階のクロマトグラフィー工程で、 高純度なT7 RNAポリメラーゼを精製しました。
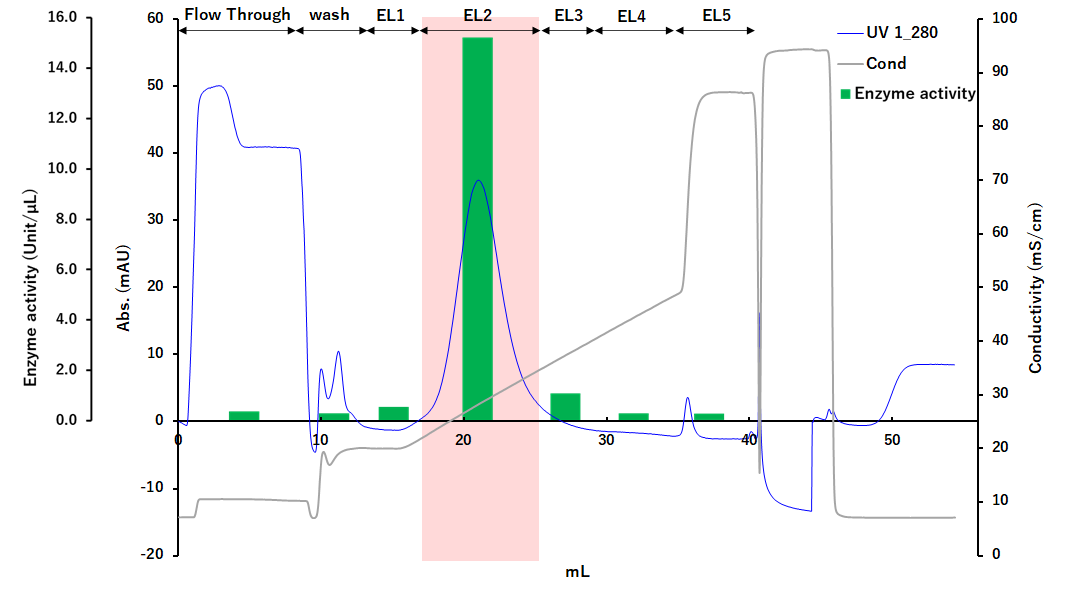
セルファインMAX DEAEで精製した後、セルファインフォスフェイトで精製しています。赤色で表示されたEL2フラクションにT7 RNAポリメラーゼが蓄積されています。
| フラクション | 酵素活性 (Unit/protein) |
酵素活性回収率 (%) |
タンパク質回収率 (%) |
| ロードサンプル | 94043 | 100 | 100 |
| 素通り画分 | 2763 | 1.8 | 59.8 |
| 溶出画分 | 267034 | 70.2 | 24.7 |
セルファイン フォスフェイトによるカラム精製後(Figure 1)の酵素活性率とタンパク質回収率をTable 1に示します。 溶出画分におけるT7 RNAポリメラーゼの活性は70.2%と高い回収率となりました。タンパク質量は24.7%まで減少したことから夾雑物が効率的に除去されていることが分かります。
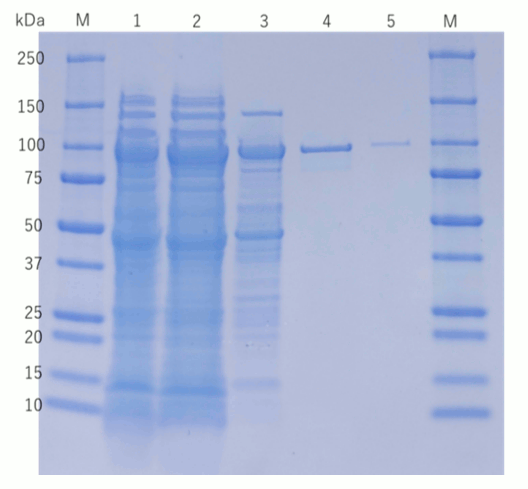
1: ライセート、2: 硫安沈殿、3: セルファインMAX DEAE溶出画分、4: セルファイン フォスフェイト溶出画分、5: 市販コントロール
セルファインMAX DEAEおよびセルファインフォスフェイトの各精製プロセスから得られたフラクションを用いてSDS-PAGEで精製度を評価しました。 クロマトグラフィーの各工程によって夾雑物が除かれ、セルファイン フォスフェイトの段階では、ほぼシングルバンドになるまでT7 RNAポリメラーゼを精製できます
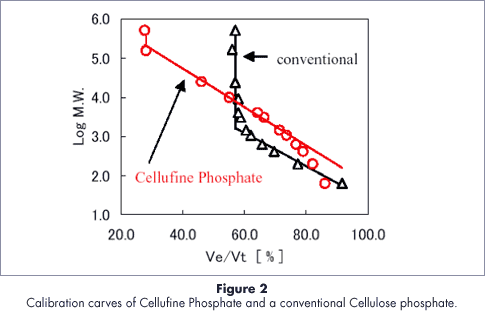
セルファイン フォスフェイトの細孔特性
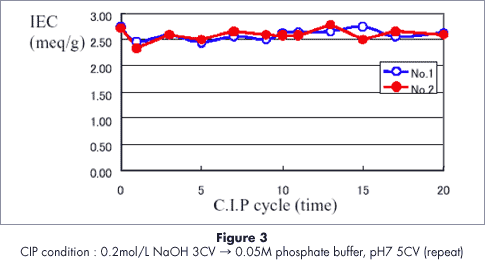
定置洗浄(CIP)安定性C.I.P. Stability test
セルファイン フォスフェイトは0.2M NaOH水溶液に安定で繰り返し使用が可能です。
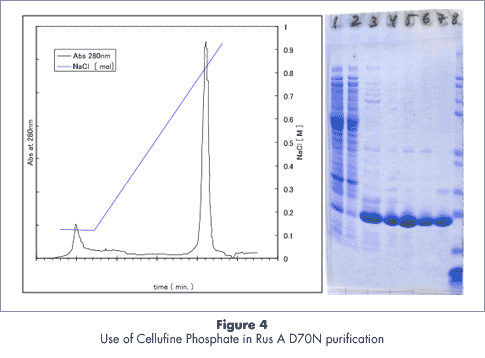
操作条件
- カラム
- 1.6x10cm (20ml)
- 流速
- 3ml/min( 90cm/h )
- サンプル
- 7.5mg RusA D70N (ヘパリン固定化担体精製後のサンプル)
- グラジエント
- 200ml、 0.1M→1.3M NaCl in 50mM tris-HCl pH 8.0
SDS-PAGE
- Gel
- Novex 4-12%BT gel used with MES-SDS running buffer (Invitrogen)
- レーン情報
- 1 細胞除去後の抽出物
2 ヘパリン固定化担体への未吸着フラクション
3 ヘパリン固定化担体吸着フラクションRusA
4-6 セルファイン ホスフェイト吸着後の溶出フラクション
7 RusA 純品サンプル
8 マーカー 12 MW standard (Invitrogen)
参考文献
Nucleic Acids Research, 2006, Vol. 00, No. 00 1–8
Rachel Macmaster, Svetlana
Sedelnikova, Patrick J. Baker, Edward L. Bolt1,Robert G. Lloyd1 and John B. Rafferty
RusA
Holliday junction resolvase: DNA complexstructure—insights into selectivity and
specificity
This data was carried by courtesy of Dr. Svetlana Sedelnikovaof the Sheffield
university.
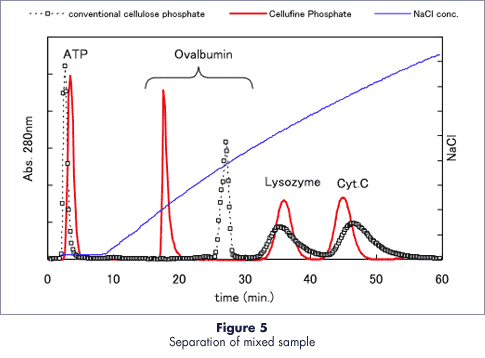
タンパク質の分離特性
セルファイン フォスフェイトは塩濃度を変化させることでタンパク質の分離が可能です。陽イオン交換体のような挙動を示しますが、一般的な陽イオン交換体よりも高塩濃度で溶出する傾向があります。
- カラム
- ID 1.1 cm – H 10 cm
- 流速
- 2 ml/min (126cm/h)
- 平衡化バッファー
- 0.01M acetate buffer, pH4.8
- 溶出バッファー
- 0 → 1 mol/L NaCl グラジエント
- セルファインTMフォスフェイト
