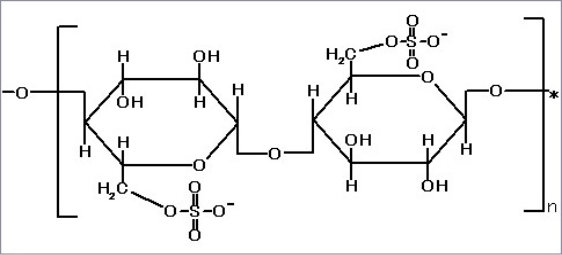
セルファインTMサルフェイト
ウイルス、ウイルス由来の抗原タンパク質、
血清タンパク質およびヘパリン結合性タンパク質の精製に利用できます。
ウイルスやウイルス由来の抗原タンパク質を精製・濃縮することでワクチン製剤や診断薬へと利用するというニーズが高まっています。セルファイン
サルフェイトは簡単な操作で、再現性良くウイルス粒子を精製・濃縮することができます。
ウイルス精製で使用されている密度勾配超遠分離は時間がかかる点、再現性がとりにくい点、安全性の観点から煩雑な操作が必要ですが、セルファイン
サルフェイトを使用することでこれらの問題を解決できます。
セルファインサルフェイトはデキストラン硫酸、コンドロイチン硫酸およびへパンリンなどを固定化した担体と比較して、コスト、リガンドの低溶出性、再現性の観点から優れた精製パフォーマンスを発揮します。
セルファイン®サルフェイトに結合した目的物は、イオン強度をステップワイズまたはグラジエントによって増加させるだけで容易に溶出できます。
特徴Features
- 生ウイルス、不活化ウイルス、スプリットされたウイルスいずれにもアフィニティー活性があります。
その他にもウイルス由来抗原、細菌由来抗原、ヘパリン結合性タンパク質とアフィニティーがあります。 - クロマトグラフィーの工程は密閉されているため、安全性が高く、目的物を微生物のコンタミネーションから守ります。
またセルファインサルフェイトはエンドトキシンとは吸着ないため、混在したエンドトキシンの除去にも有効です。 - 負に帯電したリガンドのため、エンドトキシンや宿主由来のDNAなど負に帯電した不純物を吸着しません。
- セルロースをベースとするため物理的に強固で、耐久性が高いという特徴を持ちます。
- 複数回のオートクレーブでの滅菌が可能です。
ベネフィットBenefit
- 密度勾配超遠心法よりも効率的に精製対象物から培養液や宿主細胞由来の夾雑物を除くことができます。
- 密閉されたクロマトグラフィー工程でウイルス精製が可能なため、安全性の高い精製工程となります。
- クロマトグラフィーで精製するため、密度勾配遠心分離と比較して、精製と濃縮が同時に達成できます。
従ってリードタイムの短縮とコストの削減に寄与します。 - 中性付近の穏やかな条件で吸着、溶出が可能なため、収率の向上を実現できます。
- 高い耐圧性を持つため、高流速での操作が可能です。
また製造スケールの大型カラムでの使用実績も豊富なため、スケールアップが容易です。 - 化学薬品への耐久性もあるため、例えばホルマリンを用いた滅菌も可能です。
| 製品の特長 | |
|---|---|
| ベース担体 | セルロース粒子 |
| 粒径 | ca. 40 – 130 µm |
| 粒子形状 | 真球 |
| 排除限界分子量 | 3kD |
| リガンド | 硫酸エステル基 |
| 全S含量 | >700 µg/g dry |
| タンパク質吸着量 リゾチーム : B型肝炎ウイルス表面抗原 : |
>3 mg/ml 7 mg/ml |
| 化学安定性 | 0.1M NaOHに安定, 0.1 % of 37 % ホルマリンに安定 |
| 操作圧 | <0.3 MPa |
| オートクレーブ | In suspension at neutral pH; 30 min at 121 °C |
| 保存溶液 | 20 %エタノール水溶液 |
流速特性Flow Properties
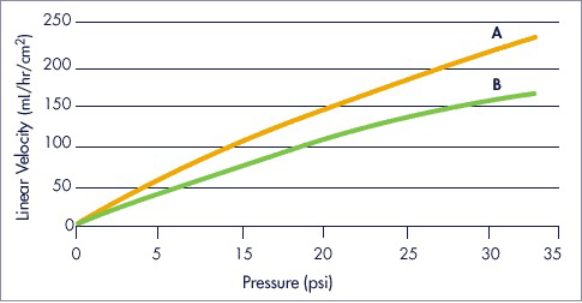
大型カラムで優れた流速特性を示します。
- Column A
- 90 x 200 mm
- Column B
- 350 x 200 mm
ウイルスおよびウイルス抗原/微生物抗原への吸着特性Virus, Viral/Microbial Antigens
| ウイルス粒子 | ウイルス/微生物抗原 |
|---|---|
|
|
| これらの実施例は特許文献から引用しています。 | |
Table 1There are many applications of Cellufine Sulfate in the concentration or
purification of viral and microbial anifigensm proteins and viruses.
ヒトコロナウイルス(OC43)の精製事例Example of purification of human coronavirus (OC43) with Cellufine Sulfate
ヒトコロナウイルス(OC43)の精製事例を示します。 コロナウイルスはエンベロープを持つタンパク質です。セルファイン サルフェイトはコロナウイルスを好適に吸着、精製することが可能です。
詳細な技術資料は以下からダウンロード可能です。
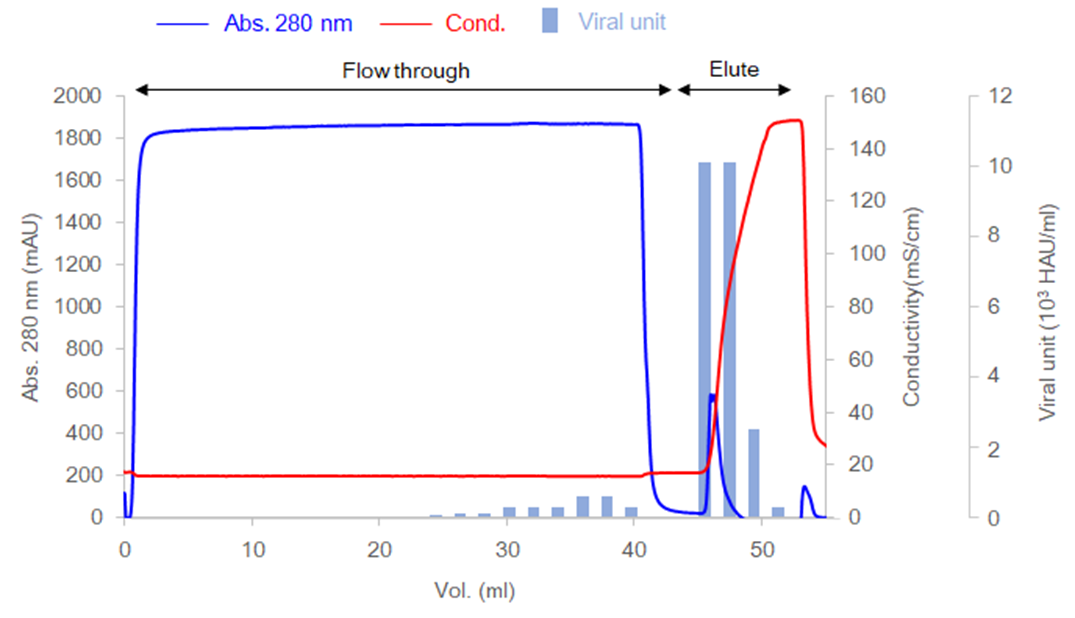
- カラム
- I.D. 5 mm x height 15 mm (0.3 ml)
- サンプル
- ベロ細胞ライセート、BPL(βプロピオラクトン)による不活化コロナウイルスを含む
- ウイルス株
- ヒトコロナウイルス(HCoV) OC43
- 流速
- 0.3 ml/min (滞留時間 1 min)
- 平衡化バッファー
- 10 mMリン酸ナトリウムバッファー, 150 mM塩化ナトリウム, pH 7.4
- 溶出バッファー
- 10 mMリン酸ナトリウムバッファー, 2 M塩化ナトリウム, pH 7.4
狂犬病ウイルスの精製事例Refinement case of a virus of rabies
Fig.3はセルファイン サルフェイトによってニワトリ胚組織の培養液から狂犬病ウイルスを濃縮・精製した実施例を示しています。
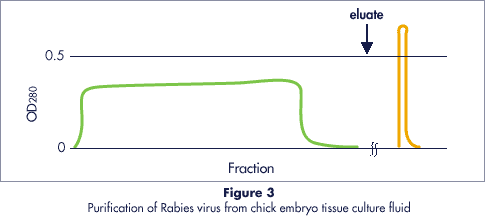
- カラム
- 50 x 70 mm (140 ml)
- 吸着バッファー
- 0.01M Phosphate (pH 7.2)
- 溶出バッファー
- 1M NaCl/0.01M Phosphate (pH 7.2)
| 通液前 | 精製後 | |
|---|---|---|
| 溶液体積 (ml) | 4,200 | 50 |
| ウイルス力価 | 32 | 4,096 |
| タンパク質量 (µg/ml) | 8.5 | 14 |
| 収率 (%) | 100 | 152 |
| 精製度 | 79x | |
| 濃縮度 | 126x |
Table 2Concetration and Purification of virus with Cellufine Sulfate
インフルエンザウイルスの精製事例Refinement case of the flu virus
インフルエンザウイルスを培養した鶏卵由来尿膜液を33.3mLのセルファイン サルフェイトに直接ロードした後、溶出させた結果、94.5%のウイルス活性を維持したまま回収することができました。
| 液量(ml) | ウイルス力価 | タンパク質量µg/ml | 回収率(%) | 精製倍率 | |
|---|---|---|---|---|---|
| 尿膜液 | 4200 | 77 | 337.1 | 100 | 1 |
| 洗浄液 | 6700 | 1 | 209.2 | 2.1 | - |
| 溶出液 | 170 | 1797 | 448.0 | 94.5 | 20.1 |
Table 3Purification of Influenza virus from hen's egg allantoic fluid
- カラム
- 50 x 170 mm
- 平衡化バッファー
- 0.01M Phosphate pH 7.4
- 洗浄バッファー
- 0.01M Phosphate pH 7.2 + 0.2M NaCl
- 溶出バッファー
- 0.01M Phosphate pH 7.0 + 1.5M NaCl
抗原タンパク質の精製と脱パイロジェンAntigenic Protein Purification and Depyrogenation
セルファイン サルフェイトはエンドトキシンを吸着させません。この特徴によりウイルスや細菌性の抽出物からエンドトキシンを除去するのに適したクロマトグラフィー充填剤と言えます。 Fig.4では百日咳菌由来の繊維状ヘマグルチニン(FHA)の精製事例を紹介しています。
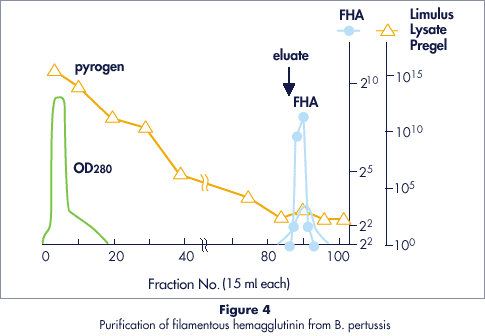
- カラム
- 16 x 70 mm (20 ml)
- サンプル
- 800 ml B. pertussis culture fluid
(endotoxin titer > 1015 by Limulus lysate test) - 平衡化バッファー
- 0.01M Phosphate (pH 7.6)
- 溶出バッファー
- 1M NaCl/0.01M Phosphate (pH 7.6)
- FHA 収量
- 94%
- 精製倍率
- 20x
- 濃縮倍率
- 28x (30 ml product)
- エンドトキシン
- リムルステスト、ウサギ、マウスの発熱試験において基準レベル以下となった。
タンパク質精製例Protein Purification
セルファイン サルフェイトはヘパリンやデキストラン硫酸のミメティック構造を有するため、これらの化合物と結合する血清由来タンパク質、細胞内増殖因子、リパーゼなどとアフィニティー活性があります。
| 吸着するタンパク質例 | 吸着しないタンパク質例 |
|---|---|
|
|
| *グラジエントモードで溶出することで良好な分離を実現することができます。 | |
Table 4
ウシ胸腺からのカゼインキナーゼⅡの精製例Purification of Partially Purified Casein Kinase II from Calf Thymus
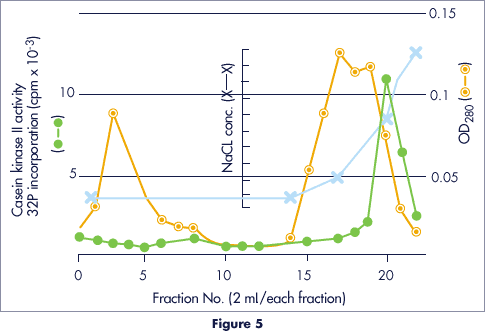
- カラム
- 10 x 20 mm
- サンプル
- 7 ml
- 平衡バッファー
- 50mM Tris-HCl (pH 7.9)
+ 50mM MgCl2
+ 0.1mM EDTA
+ 0.1mM PMS
+ 0.5mM DTT
+ 25 % glycerol - 溶出バッファー
- 0.05 – 1.0M NaCl in buffer
